Bahan & metode: Fibrin kaya platelet lanjutan
Produksi PRF Choukroun
Perancah PRF disiapkan sesuai protokol yang dipublikasikan sebelumnya.11,26 Empat sukarelawan saras (yaitu, tanpa sejarah penggunaan antikoagulan) dalam rentang yuswa antara 18 sampai 60 tahun ikut serta dalam penelitian ini. Untuk setiap peserta penelitian, 4 tabung darah perifer dikumpulkan dan segera ditempatkan dalam centrifuge yang telah diprogram sebelumnya (PC-O2, PROSES for PRF, Nice, Prancis). Sentrifugasi dilakukan sesuai dua protokol berikut:
- PRF standar, tabung plastik berlapis kaca steril (9 mL; 2.700 rpm selama 12 menit)
- PRF lanjutan, tabung vakum berbasis kaca steril biasa (tabung A-PRF10 ) (10 mL; 1500 rpm selama 14 menit).
Persiapan histologis
Pemrosesan jaringan
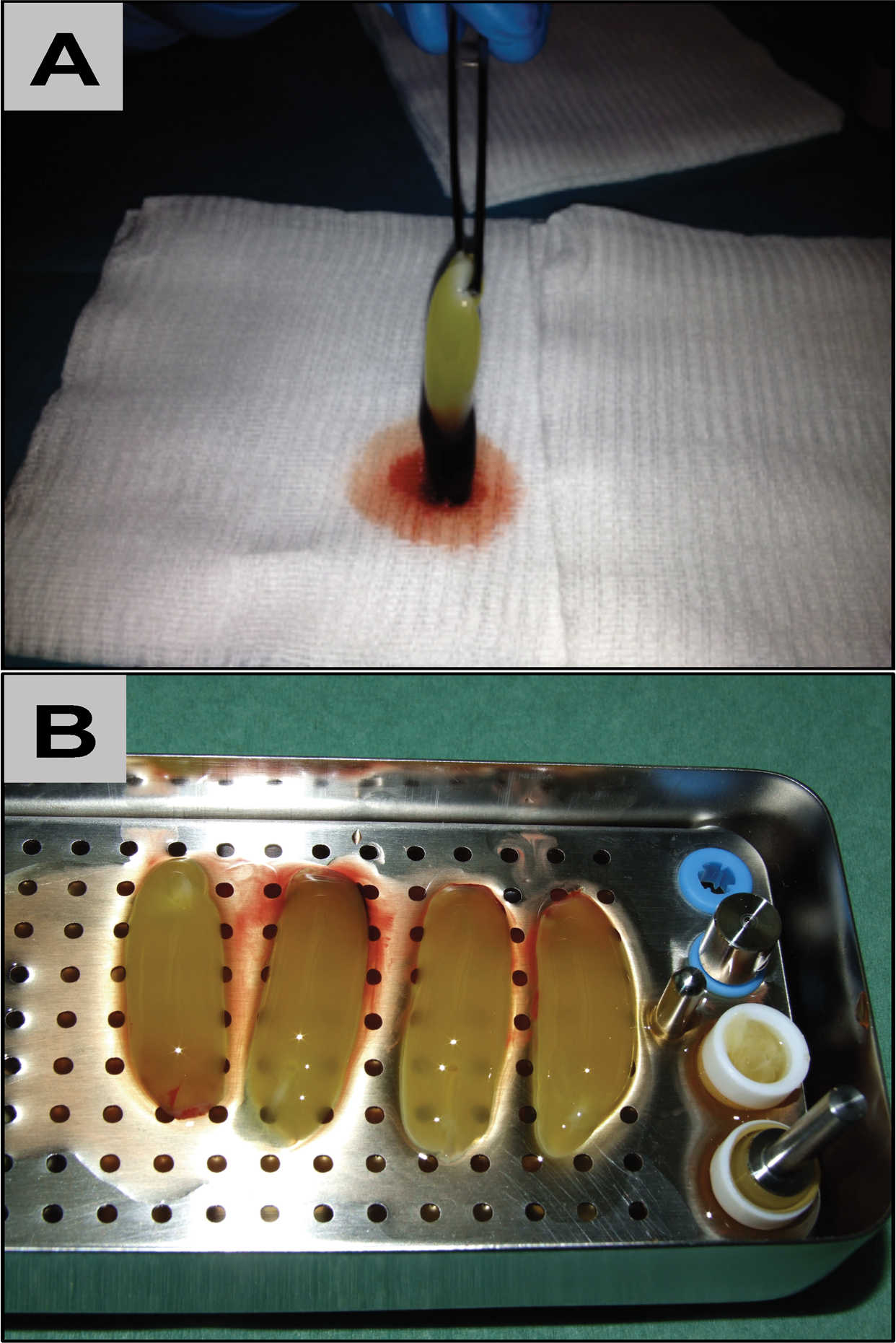
Setelah sentrifugasi, gumpalan darah diambil dengan hati-hati dari tabung. Fraksi sel darah merah (RBC) dihapus sedemikian rupa sehingga bagian bawah gumpalan yang kaya fibrin tidak rusak. Teknik ini dijelaskan secara lebih rinci dalam protokol Choukroun.11,26 Jejak mengenai bentuk gumpalan diberikan pada Gambar 1. Gumpalan berbasis fibrin dengan buffy coat (BC) dan bagian dari RBC kemudian diperbaiki dengan 4% larutan paraformaldehida selama 24 jam. Setelah itu, gumpalan itu dipotong dan ditempatkan di sepanjang sumbu longitudinal dalam kaset yang melekat.
Histologi dan histokimia
Untuk analisis mikroskopis lebih lanjut, sampel diproses secara kimia dalam seri alkohol dan xilena seperti yang dijelaskan sebelumnya. Selanjutnya, pelekatan parafin dilakukan, dan 10 bagian dengan ketebalan 2 sampai 4 μm dipotong dengan mikrotom putar (Leica RM2255, Wetzlar, Jerman) dan ditempel pada slide kaca yang diisi ulang (SuperFrost Plus, Thermo Scientific, Waltham, Mass). Sebelum pewarnaan, sampel menjalani proses deparaffinisasi dan rehidrasi dengan pencelupan berurutan dalam xylene diikuti dengan penurunan konsentrasi etanol. Beberapa metode pewarnaan histokimia dan imunohistokimia kemudian dilakukan, sebagaimana yang dijelaskan sebagai berikut ini.
Tiga sampel diwarnai secara histologis dengan protokol standar untuk hematoxylin dan eosin (H&E) dan teknik trikoma Masson-Goldner, karena metode pewarnaan histokimia mligi ini membisakan pembedaan komponen gumpalan, yaitu antara sel dan protein matriks seperti fibrin.1,2 Enam bagian lainnya digunakan untuk mengidentifikasi berbagai penanda (lihat Tabel) melalui pewarnaan imunohistokimia dalam autostainer (DAKO, Hamburg, Jerman) di Institute of Pathology, Universitas Johann Wolfgang Goethe Frankfurt, Jerman.
| Tipe | |||||
|---|---|---|---|---|---|
| Antibodi | Sel target | Klon | (mono atau poly) | Epitope demasking | Konsentrasi |
| Anti-CD3 | T-limfosit | - | Kelinci poliklon anti-human |
Tris-EDTA, pH 8.0 | 1:200 |
| Anti-CD15, sesuai referensi | Granulosit neutrofilik | Carb-3 | Mencit monoklon anti-human |
Tris-EDTA, pH 8.0 | RTU |
| Anti-CD20cy | B-limfosit | Clone 126 | Mencil monoklon anti-human |
Tris-EDTA, pH 8.0 | 1:1000 |
| Anti-CD34 kelas II | Sel induk | Clone QBend-10 |
Mencit monoklon anti-human |
Tris-EDTA, pH 8.0 | RTU |
| Anti-CD61 platelet glycoprotein lila | Platelet | Y2/51 | Mencit monoklon anti-human |
Tris-EDTA, pH 8.0 | 1:500 |
| Anti-CD68 | Monosit | KP1 | Mencit monoklon anti-human |
Tris-EDTA, pH 8.0 | RTU |
Imunohistokimia
Setelah menetapkan konsentrasi antibodi optimal untuk masing-masing penanda yang disebutkan di atas (DAKO), slide ditempatkan di rak dan diinkubasi dalam Tris-EDTA pH 8.0 pada 96°C selama 20 menit. Selanjutnya, slide dibilas dengan air ledeng untuk mendinginkan. Kemudian, slide dicuci dengan TBS dan dipindahkan ke pewarna otomatis (autostainer). Sebelum memulai autostainer, antibodi dan solusi yang diperlukan dimasukkan ke dalam autostainer sesuai dengan instruksi pabrikan. Sistem deteksi DAKO EnVision digunakan. Setelah autostaining, slide dinyalakan kembali dengan hemalun selama 30 detik dan dicuci dengan air ledeng. Purnanya, slide yang diwarnai ditutup dengan media pemasangan Aquatex berbasis air (Merck, Germany).
Evaluasi histologis
Pemeriksaan histologis dilakukan pakai mikroskop cahaya (Nikon Eclipse 80i, Tokyo, Jepang). Fotograf resolusi tinggi diambil dengan Nikon DS-Fi1/ Digital kamera dan Nikon Digital Sight unit DS-L2 dalam kondisi terkoneksi.
Histomorfometri
Untuk analisis histomorfometrik, keenam slide yang diwarnai secara imunohistokimia dari setiap bekuan dipindai pakai mikroskop Nikon Eclipse 80i yang dilengkapi dengan tabel pemindaian otomatis (Prior Scientific, Rockland, Maine), kamera digital Nikon DS-Fi / 1 dan komputer dengan perangkat lunak Nikon NIS - Elements AR, versi 4.0. Kombinasi ini membisakan pengambilan gambar resolusi tinggi tunggal dan perakitan gambar tunggal berikutnya menjadi satu gambar lengkap (yaitu, "pemindaian total").
Analisis histomorfometrik berikut dari penetrasi sel komparatif dalam gumpalan dilakukan juga menggunakan fungsi pengukuran NIS - perangkat lunak Elemen. Oleh karena itu, panjang total setiap gumpalan diukur pada mulanya (dalam mikrometer), dan setelah itu, panjang "penetrasi" dari macam sel berikut juga ditentukan (dalam mikrometer): sel induk, T-limfosit dan B-limfosit, neutrofilik granulosit, trombosit, dan monosit. Purnanya, distribusi macam sel yang berbeda dimasukkan ke dalam konteks dalam panjang gumpalan masing-masing, sehingga membisakan ekspresi "penetrasi" panjang dalam persen (yaitu, "penetrasi sel relatif") untuk perbandingan statistik berikutnya.
Evaluasi statistik
Analisis statistik dilakukan pakai data dari dua kelompok eksperimen yang berbeda (yaitu, dengan n = 4 sampel di setiap kelompok). Kedalaman penetrasi kemudian dibandingkan secara statistik. Data yang diperoleh metuken rerata ± S.E.M. dengan bantuan analisis varian 1 arah dan beberapa tes post-hoc perbandingan Bonferroni melalui GraphPad Prism versi 6.0 (Perangkat Lunak GraphPad, La Jolla, California). Dengan demikian, signifikansi statistik antar individu dan intra-individu dilaporkan sebagai signifikan (• / *, masing-masing) pada P <0,05, dan sangat signifikan (•• / **) pada P <0,01 dan (•• • / ***) di P <.001. Purnanya, data kuantitatif disajikan secara grafis sebagai rerata ± standar deviasi (SD).
Serial posts:
- Fibrin Kaya Platelet Lanjutan (A-PRF)
- Bahan & metode: Fibrin kaya platelet lanjutan
- Wedharan: Fibrin Kaya Platelet Lanjutan (A-PRF)